Список ступенів окислення хімічних елементів
Перейти до навігації
Перейти до пошуку
Цей список показує всі відомі ступені окислення хімічних елементів. Винятками є дробові значення. Ступені окислення, що найбільш часто зустрічаються виділені жирним шрифтом. Цей список заснований на таблиці Грінвуда[1] з усіма доповненнями. В колонку, в якій ступінь окиснення дорівнює нулю, вписані інертні гази. Дана таблиця базується на даних Д. В. Менделєєва.
| −1 | H | +1 | ||||||||||||
| He | ||||||||||||||
| Li | +1 | |||||||||||||
| Be | +1 | +2 | ||||||||||||
| -3 | −1 | B | +1 | +2 | +3 | |||||||||
| −4 | −3 | −2 | −1 | C | +1 | +2 | +3 | +4 | ||||||
| −3 | −2 | −1 | N | +1 | +2 | +3 | +4 | +5 | ||||||
| −2 | −1 | O | +1 | +2 | ||||||||||
| −1 | F | |||||||||||||
| Ne | ||||||||||||||
| Na | +1 | |||||||||||||
| Mg | +1 | +2 | [2] | |||||||||||
| Al | +3 | |||||||||||||
| −4 | −3 | −2 | −1 | Si | +1 | +2 | +3 | +4 | ||||||
| −3 | −2 | −1 | P | +1 | +2 | +3 | +4 | +5 | ||||||
| −2 | −1 | S | +1 | +2 | +3 | +4 | +5 | +6 | ||||||
| −1 | Cl | +1 | +2 | +3 | +4 | +5 | +6 | +7 | ||||||
| Ar | ||||||||||||||
| K | +1 | |||||||||||||
| Ca | +2 | |||||||||||||
| Sc | +1 | +2 | +3 | |||||||||||
| Ti | +2 | +3 | +4 | |||||||||||
| V | +1 | +2 | +3 | +4 | +5 | |||||||||
| Cr | +1 | +2 | +3 | +4 | +5 | +6 | ||||||||
| Mn | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||||||
| Fe | +1 | +2 | +3 | +4 | +5 | +6 | ||||||||
| Co | +1 | +2 | +3 | +4 | +5 | |||||||||
| Ni | +1 | +2 | +3 | +4 | ||||||||||
| Cu | +1 | +2 | +3 | |||||||||||
| Zn | +2 | |||||||||||||
| Ga | +1 | +2 | +3 | |||||||||||
| −4 | Ge | +1 | +2 | +3 | +4 | |||||||||
| −3 | As | +2 | +3 | +5 | ||||||||||
| −2 | Se | +2 | +4 | +6 | ||||||||||
| −1 | Br | +1 | +3 | +4 | +5 | +7 | ||||||||
| Kr | +2 | |||||||||||||
| Rb | +1 | |||||||||||||
| Sr | +2 | |||||||||||||
| Y | +1 | +2 | +3 | [3][4] | ||||||||||
| Zr | +1 | +2 | +3 | +4 | ||||||||||
| −1 | Nb | +2 | +3 | +4 | +5 | |||||||||
| −2 | −1 | Mo | +1 | +2 | +3 | +4 | +5 | +6 | ||||||
| −3 | −1 | Tc | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||||
| −2 | Ru | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | |||||
| −1 | Rh | +1 | +2 | +3 | +4 | +5 | +6 | |||||||
| Pd | +2 | +4 | ||||||||||||
| Ag | +1 | +2 | +3 | |||||||||||
| Cd | +2 | |||||||||||||
| In | +1 | +2 | +3 | |||||||||||
| −4 | Sn | +2 | +4 | |||||||||||
| −3 | Sb | +3 | +5 | |||||||||||
| −2 | Te | +2 | +4 | +5 | +6 | |||||||||
| −1 | I | +1 | +3 | +5 | +7 | |||||||||
| Xe | +2 | +4 | +6 | +8 | ||||||||||
| Cs | +1 | |||||||||||||
| Ba | +2 | |||||||||||||
| La | +2 | +3 | ||||||||||||
| Ce | +2 | +3 | +4 | |||||||||||
| Pr | +2 | +3 | +4 | |||||||||||
| Nd | +2 | +3 | ||||||||||||
| Pm | +3 | |||||||||||||
| Sm | +2 | +3 | ||||||||||||
| Eu | +2 | +3 | ||||||||||||
| Gd | +1 | +2 | +3 | |||||||||||
| Tb | +1 | +3 | +4 | |||||||||||
| Dy | +2 | +3 | ||||||||||||
| Ho | +3 | |||||||||||||
| Er | +3 | |||||||||||||
| Tm | +2 | +3 | ||||||||||||
| Yb | +2 | +3 | ||||||||||||
| Lu | +3 | |||||||||||||
| Hf | +2 | +3 | +4 | |||||||||||
| −1 | Ta | +2 | +3 | +4 | +5 | |||||||||
| −2 | −1 | W | +1 | +2 | +3 | +4 | +5 | +6 | ||||||
| −3 | −1 | Re | +1 | +2 | +3 | +4 | +5 | +6 | +7 | |||||
| −2 | −1 | Os | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | ||||
| −3 | −1 | Ir | +1 | +2 | +3 | +4 | +5 | +6 | +7 | +8 | +9 | [5] | ||
| Pt | +2 | +4 | +5 | +6 | ||||||||||
| −1 | Au | +1 | +2 | +3 | +5 | |||||||||
| Hg | +1 | +2 | +4 | |||||||||||
| Tl | +1 | +3 | ||||||||||||
| −4 | Pb | +2 | +4 | |||||||||||
| −3 | Bi | +3 | +5 | |||||||||||
| −2 | Po | +2 | +4 | +6 | ||||||||||
| −1 | At | +1 | +3 | +5 | ||||||||||
| Rn | +2 | +4 | +6 | |||||||||||
| Fr | +1 | |||||||||||||
| Ra | +2 | |||||||||||||
| Ac | +3 | |||||||||||||
| Th | +2 | +3 | +4 | |||||||||||
| Pa | +3 | +4 | +5 | |||||||||||
| U | +3 | +4 | +5 | +6 | ||||||||||
| Np | +3 | +4 | +5 | +6 | +7 | |||||||||
| Pu | +3 | +4 | +5 | +6 | +7 | |||||||||
| Am | +2 | +3 | +4 | +5 | +6 | |||||||||
| Cm | +3 | +4 | ||||||||||||
| Bk | +3 | +4 | ||||||||||||
| Cf | +2 | +3 | +4 | |||||||||||
| Es | +2 | +3 | ||||||||||||
| Fm | +2 | +3 | ||||||||||||
| Md | +2 | +3 | ||||||||||||
| No | +2 | +3 | ||||||||||||
| Lr | +3 | |||||||||||||
| Rf | +4 |
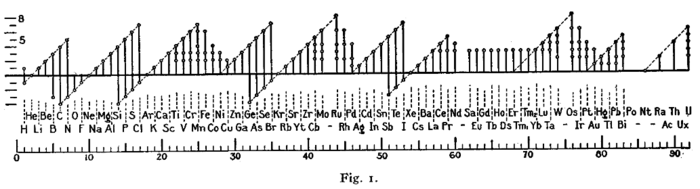
Аналогічний графік був використаний Ірвінгом Ленгмюром в 1919 році у своїх ранніх стадіях вивчення правила октету[6].
- ↑ Greenwood, Norman N.; Earnshaw, A. Chemistry of the. — 2-е изд. — Oxford : Butterworth-Heinemann, 1997. — С. 28. — ISBN 0080379419.
- ↑ S. P., Green. Stable Magnesium(I) Compounds with Mg-Mg Bonds / Jones C.; Stasch A.. — Журнал Science, 2007. — Вип. 318. — № 5857 (December). — С. 1754—1757. — DOI:. — PMID 17991827 .
- ↑ Yttrium: yttrium(II) hydride compound data. WebElements.com. Архів оригіналу за 13 травня 2008. Процитовано 11 вересня 2010.
- ↑ Yttrium: yttrium(I) bromide compound data. OpenMOPAC.net. Архів оригіналу за 23 липня 2011. Процитовано 11 вересня 2010.
- ↑ DOI:10.1002/anie.201410615
Нема шаблону {{Cite doi/10.1002/anie.201410615}}.заповнити вручну - ↑ Irving Langmuir. The arrangement of electrons in atoms and molecules. — Журнал J. Am. Chem. Soc., 1919. — Вип. 41 (4 листопада). — С. 868—934. — DOI:.